De menselijke hersenen zijn biologisch het meest verfijnd beschermde orgaan en paradoxaal genoeg, door die beschermingsmechanismen, blijven ze een 'onoverwinnelijke vesting' die het moeilijkst te behandelen is. Onder hen wordt glioblastoom (Glioblastoma, GBM) geclassificeerd als de meest dodelijke en destructieve kwaadaardige tumor in het gebied van de neurochirurgie. Op 2 februari 2026 werd het team van professor Ansdavan van de neurochirurgie van het St. Mary's Hospital in Seoul geselecteerd voor het project 'Innovatieve onderzoek - Pioniersonderzoek' van het Ministerie van Wetenschap en ICT, waarmee ze begonnen aan het onderzoek naar 'intranasale toediening van geadopteerde immuunceltherapie', een gedurfde uitdaging om de historische problemen van glioblastoombehandeling op te lossen.
Glioblastoom is de meest voorkomende primaire kwaadaardige hersentumor bij volwassenen, goed voor ongeveer 15% van alle hersentumoren en ongeveer 45-50% van de kwaadaardige hersentumoren. In het binnenland komt het voor bij ongeveer 5 mensen per 100.000 inwoners per jaar, met jaarlijks 600-800 nieuwe patiënten die gediagnosticeerd worden.
Extreem lage overlevingskans: Zelfs met de huidige standaardbehandeling, de 'postoperatieve temozolomide (Temozolomide) chemoradiotherapie (Stupp Protocol)', is de gemiddelde overlevingstijd (Median Overall Survival) van patiënten slechts 12-15 maanden. De 5-jaarsoverlevingskans is minder dan 7-10%, wat suggereert dat het een van de ergste kankertypes is die de moderne geneeskunde niet heeft overwonnen.
Hoge terugvalratio: Glioblastoom vertoont een invasief groeipatroon, waardoor zelfs als de zichtbare tumor chirurgisch wordt verwijderd, er nog steeds microscopische kankercellen in het omliggende normale hersenweefsel achterblijven, wat leidt tot terugval bij meer dan 90% van de patiënten. Na terugval zijn er geen geschikte standaardbehandelingen en wordt de overlevingstijd met enkele maanden verkort.
De reden waarom de behandeling van glioblastoom herhaaldelijk faalt, is te wijten aan twee enorme barrières.
Fysieke barrière (Blood-Brain Barrier, BBB): De endotheelcellen van de hersenvaten zijn verbonden door strakke juncties (Tight Junctions), waardoor meer dan 98% van de stoffen in het bloed worden geblokkeerd. De meeste medicijnen met een molecuulgewicht van meer dan 400 dalton (Da) kunnen deze barrière niet passeren, en vooral grote moleculen zoals antilichaamtherapieën of immuuncellen hebben bij systemische toediening (intraveneuze injectie) een bereik van minder dan 0,1% in het hersenweefsel. Dit veroorzaakt het probleem van 'leveringsfalen', zelfs als krachtige chemotherapiemiddelen worden ontwikkeld.
Immunologische barrière: Glioblastoom is een typisch 'koud tumor'. Er is weinig infiltratie van T-cellen in de tumor, en tumorcellen scheiden krachtige immunosuppressieve stoffen (zoals TGF-β) uit, waardoor zelfs de infiltrerende immuuncellen worden geneutraliseerd. Hierdoor hebben immunotherapieën zoals PD-1-remmers, die opmerkelijke effecten vertoonden bij melanoom of longkanker, een verwoestende mislukking ervaren bij de behandeling van glioblastoom alleen.
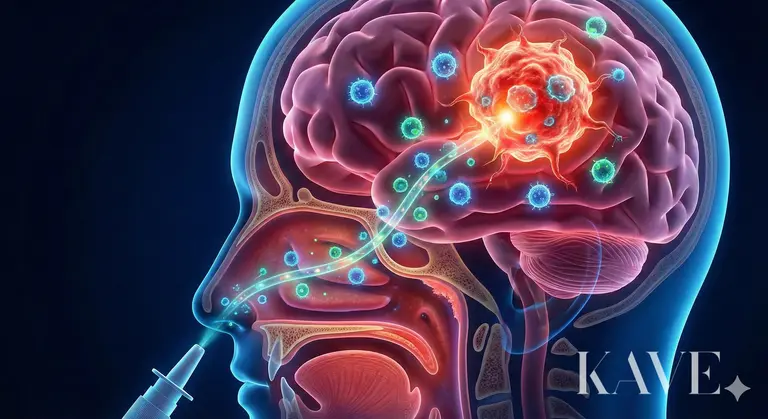
Het onderzoek van professor Ansdavan biedt een innovatieve benadering die beide barrières gelijktijdig omzeilt en aanvalt, namelijk het inzetten van 'versterkte immuuncellen (Cell)' via een omweg genaamd 'neus (Nose)'.
De inspanningen van de mensheid om de bloed-hersenbarrière (BBB) te overwinnen, zijn al tientallen jaren aan de gang. Het gieten van hoge doses chemotherapie heeft geleid tot systemische toxiciteit (beenmergsuppressie, levertoxiteit), en het tijdelijk openen van de BBB met mannitol brengt het risico van hersenoedeem met zich mee. Onlangs zijn er technieken geprobeerd om de BBB lokaal te openen met behulp van ultrasone geluiden, maar dit vereist nog steeds apparatuur en een complex proces. De intranasale toediening, waar professor Ansdavan zich op richt, maakt gebruik van de enige anatomische doorgang in het menselijk lichaam die de externe omgeving en het centrale zenuwstelsel (CZS) direct verbindt.
In het bovenste deel van de neus bevindt zich het olfactorisch epitheel (Olfactory Epithelium), waar olfactorische zenuwcellen zijn blootgesteld. De axonen (Axon) van deze zenuwcellen zijn direct verbonden met de olfactorische bulb in de hersenen via kleine openingen in het zeefbeen (Cribriform plate).
Perineurale ruimte: Geneesmiddelen of cellen kunnen zich ook binnenin de zenuwcellen (Intraneuronal) verplaatsen, maar het is waarschijnlijker dat ze zich verplaatsen via de perineurale ruimte die de zenuwbundel omringt. Deze ruimte is continu met de subarachnoïdale ruimte (Subarachnoid space) waar het hersenvocht (CSF) stroomt, en als het hier doorheen gaat, kan het de hersenen binnendringen zonder de bloed-hersenbarrière te passeren.
Snelheid: Transport binnenin de zenuw is een langzaam proces dat dagen kan duren, terwijl extracellulair transport via de perineurale ruimte een snelweg kan zijn die binnen enkele minuten de hersenweefsels bereikt.
Als de olfactorische zenuw is verbonden met de voorkant van de hersenen (in de buurt van de frontale kwab), dan is de trigeminuszenuw (Trigeminal Nerve), die wijd verspreid is over het neusslijmvlies, verbonden met de hersenstam (Brainstem) en de pons. Het onderzoek van professor Ansdavan heeft als doel om immuuncellen niet alleen naar de voorkant van de hersenen, maar ook naar tumoren die zich diep in de hersenen bevinden, te transporteren. Het onderzoeksteam heeft al de mogelijkheden getest via dierproeven voordat dit nationale project werd geselecteerd. In eerdere studies werd bevestigd dat immuuncellen zoals CAR-T (chimeric antigen receptor T-cellen) effectief naar de hersentumorgebieden migreren en significante antitumoreffecten vertonen wanneer ze intranasale toediening krijgen. Dit is mogelijk omdat levende cellen de 'homing' capaciteit benutten om actief de tumor te vinden, in plaats van alleen maar het medicijn te laten diffunderen, door chemokine signalen te volgen.
'Adoptieve celtherapie (Adoptive Cell Therapy, ACT)' is een behandelingsmethode waarbij immuuncellen uit het lichaam van de patiënt worden geëxtraheerd, versterkt/gewijzigd en vervolgens opnieuw worden geïnjecteerd. Het team van professor Ansdavan gebruikt niet alleen eenvoudige immuuncellen, maar hooggeëngineerde cellen die zijn afgestemd op de kenmerken van glioblastoom. Recentelijk zijn CAR-T cellen, die opmerkelijke effecten hebben vertoond bij bloedkanker, T-cellen die zijn uitgerust met receptoren (CAR) die specifieke eiwitten op de oppervlakte van kankercellen herkennen.
Doelwit: In het geval van glioblastoom zijn EGFRvIII (een gemuteerd eiwit dat niet in normale cellen voorkomt, maar alleen in glioblastoom) en IL13Rα2 de belangrijkste doelwitten.
Voordelen van intranasale toediening: CAR-T cellen die intraveneus worden toegediend, hebben het probleem dat ze vast komen te zitten in de longen of de lever (First-pass effect), maar bij intranasale toediening kunnen ze direct naar de hersenen gaan zonder systemische verliezen, waardoor een hoge therapeutische effectiviteit met een lagere dosis kan worden verwacht.
Professor Ansdavan heeft zich ook gericht op onderzoek naar NK-cellen (natuurlijke killercellen) en gamma-delta T-cellen. Glioblastoom kan zijn doelwit-eiwitten verbergen (Antigen Loss) om de aanval van CAR-T cellen te vermijden, maar NK-cellen zijn aangeboren immuuncellen die deze ontwijkingsmechanismen negeren en kankercellen kunnen aanvallen. Het onderzoeksteam bouwt een platform dat verschillende 'wapens' zoals CAR-T, NK, gamma-delta T-cellen kan vervoeren via de intranasale route, afhankelijk van de kenmerken van de patiënt.
Een van de meest originele prestaties van het team van professor Ansdavan is de behandelingsmethode met behulp van genetisch gemodificeerde stamcellen. Volgens een studie gepubliceerd in 2025 in het internationale tijdschrift Biomedicine & Pharmacotherapy, heeft het onderzoeksteam interleukine-12 (IL-12) genen ingebracht in mesenchymale stamcellen (MSC) die een uitstekende tumor-tropisme hebben.
Mechanisme: MSC die intranasale of lokale toediening krijgen, dringen diep in de tumor door.
Actie: MSC scheiden IL-12 uit binnenin de tumor. IL-12 is een krachtige immuunactiverende cytokine die slapende NK-cellen en T-cellen in de buurt wekt om de tumor aan te vallen.
Resultaten: Toen deze behandeling werd gecombineerd met PD-1 immunotherapie, vertoonde het een 50% volledige remissie (Complete Remission) in muismodellen, en zelfs na het opnieuw injecteren van kankercellen na de behandeling werd de 'immunologische geheugen (Immunological Memory)' effect bewezen, waarbij geen terugval optrad.
Het onderzoek van professor Ansdavan is geen geïsoleerde poging, maar staat aan de voorhoede van de wereldwijde concurrentie in de ontwikkeling van next-generation hersentumorbehandelingstechnologie. In vergelijking met belangrijke onderzoeksteams in de Verenigde Staten heeft het team van het St. Mary's Hospital in Seoul een unieke positie in de combinatie van 'niet-invasief' en 'celengineering'.
In 2025 publiceerde het onderzoeksteam van de Universiteit van Pennsylvania baanbrekende klinische resultaten in Nature Medicine. Ze slaagden erin om de tumoromvang te verminderen door 'dual-target (Dual-Target) CAR-T' toe te dienen aan patiënten met recidiverend glioblastoom, die zowel EGFRvIII als IL13Rα2 aanvielen.
Beperkingen: Het Penn-team boorde gaten in de schedel om cellen naar de hersenen te sturen en plaatste een buis genaamd 'Ommaya reservoir' om direct in de hersenholte te injecteren. Dit is een zekere methode van toediening, maar vereist chirurgie, brengt infectierisico's met zich mee en veroorzaakt veel pijn bij de patiënt.
Vergelijking: De intranasale toedieningsmethode van het team van Ansdavan heeft het potentieel om een 'Game Changer' te zijn die vergelijkbare effecten kan bereiken zonder deze chirurgische ingreep.
Het onderzoeksteam van de Universiteit van Washington publiceerde in 2025 in PNAS de resultaten van het behandelen van glioblastoom door het toedienen van nanodeeltjes genaamd 'sferische nucleïnezuren (Spherical Nucleic Acids)' via de neus.
Benadering: Gouden nanodeeltjes werden gecoat met immuunactiverende stoffen en intranasale toediening werd gebruikt om de immuunomgeving van de hersentumor te activeren.
Vergelijking: De methode van WashU richtte zich op de levering van 'geneesmiddelen (nanodeeltjes)', terwijl het team van Ansdavan 'cellen (Cell)' levert. Cellen zijn, in tegenstelling tot medicijnen, levende behandelingen die zich zelf kunnen verplaatsen, zich kunnen vermenigvuldigen en kunnen reageren op veranderingen in de tumor, waardoor ze mogelijk beter in staat zijn om de complexe micro-omgeving van glioblastoom te overwinnen.
Dit onderzoek, dat wordt uitgevoerd met de steun van het Ministerie van Wetenschap en ICT (300 miljoen won gedurende 3 jaar), richt zich op het verkrijgen van concrete gegevens voor klinische toepassing, voorbij de basisexperimenten.
Padmapping (Mapping): Door gebruik te maken van fluorescerende gemerkte immuuncellen, wordt visueel vastgesteld welke route de cellen voornamelijk gebruiken via intranasale toediening, of ze de olfactorische zenuw of de trigeminuszenuw gebruiken, en in welke delen van de hersenen ze zich ophopen.
Cellenengineering: Technologie wordt toegepast om eiwitten (bijv. chemokine receptor CXCR4) te over-expressen op het oppervlak van immuuncellen, zodat ze beter hechten aan het zenuwslijmvlies of sneller door de perineurale ruimte kunnen bewegen. Dit is bedoeld om te voorkomen dat cellen worden afgevoerd door snot of niezen en om de efficiëntie van de verplaatsing naar de hersenen te maximaliseren.
Veiligheids- en toxiciteitsbeoordeling: Er wordt gecontroleerd of de immuuncellen die de hersenen bereiken, geen neurotoxiciteit (Neurotoxicity) veroorzaken door normale hersencellen aan te vallen of overmatige ontstekingsreacties te veroorzaken.
Professor Ansdavan verklaarde in een interview: "Als dit onderzoek wordt gevestigd, kan het zich ontwikkelen tot een 'universeel platform' dat niet alleen toepasbaar is op glioblastoom, maar ook op andere centrale zenuwstelselaandoeningen zoals hersenmetastasen, Alzheimer en de ziekte van Parkinson." De technologie om 'cellen' niet-chirurgisch naar de hersenen te sturen, kan ook worden toegepast om stamcellen te leveren voor het regenereren van zenuwen bij degeneratieve hersenaandoeningen.
Glioblastoom is de afgelopen decennia het graf geweest van talloze nieuwe medicijnen. De ondoordringbare bloed-hersenbarrière en de immunologische kenmerken van koude tumoren hebben bestaande chemotherapie-strategieën ondermijnd. Echter, de 'intranasale toediening van geadopteerde immuunceltherapie' van het team van professor Ansdavan van het St. Mary's Hospital in Seoul wordt beschouwd als een innovatieve doorbraak die deze impasse kan doorbreken.
Als dit onderzoek succesvol wordt uitgevoerd, zal de volgende toekomst zich openen.
Verbetering van de kwaliteit van leven van patiënten: Patiënten zullen in staat zijn om immuunceltherapie te ontvangen in de polikliniek in de vorm van neusspray of druppels, zonder herhaalde craniotomieën of ziekenhuisopnames, wat hun lijden aanzienlijk zal verlichten.
Verhoogde behandelings efficiëntie: Door hoge concentraties immuuncellen direct naar de hersentumor te richten zonder systemische bijwerkingen die optreden bij intraveneuze toediening, kan de therapeutische effectiviteit worden gemaximaliseerd.
Voorkoming van terugval: Door het vormen van immunologisch geheugen kan de grootste uitdaging van glioblastoom, terugval, mogelijk volledig worden geblokkeerd.
Het onderzoek van professor Ansdavan is niet alleen gericht op het ontwikkelen van nieuwe medicijnen, maar op het innoveren van de 'routes' voor medicijnafgifte en het ontwerpen van 'cellen' die zijn geoptimaliseerd voor die routes. De driejarige onderzoeksperiode die in 2026 begint, zal een belangrijk keerpunt zijn voor Korea om een 'First Mover' te worden in het wereldwijde veld van neuro-oncologie. We zijn nu getuige van een keerpunt in de geschiedenis waarbij glioblastoom, dat ooit als een ongeneeslijke ziekte werd beschouwd, verandert in een 'beheersbare chronische ziekte' of een 'geneesbare ziekte'.

