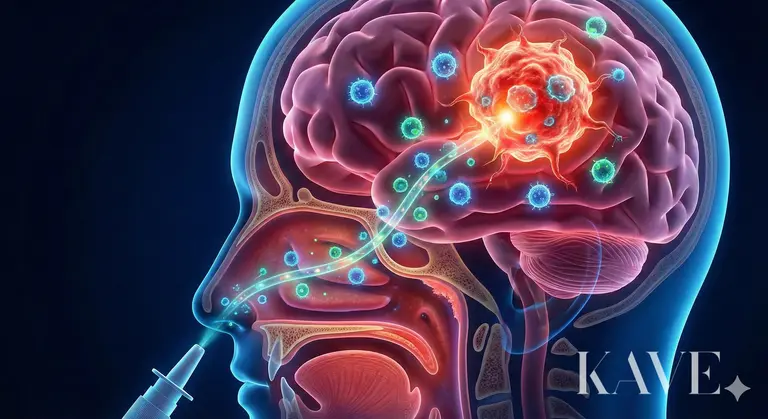
Das menschliche Gehirn ist biologisch das am besten geschützte Organ und bleibt paradoxerweise aufgrund seiner Schutzmechanismen eine 'uneinnehmbare Festung', die schwer zu behandeln ist. Unter diesen ist Glioblastom (Glioblastoma, GBM) der tödlichste und zerstörerischste bösartige Tumor im Bereich der Neurochirurgie. Am 2. Februar 2026 wurde das Professorenteam von Ahn Se-deban an der St. Mary's Hospital der Katholischen Universität Seoul für das Projekt 'Intranasale Verabreichung adoptiver Immunzelltherapie' ausgewählt, das eine kühne Herausforderung darstellt, um die historische Herausforderung der Behandlung von Glioblastomen zu lösen.
Glioblastom ist der häufigste primäre bösartige Gehirntumor bei Erwachsenen und macht etwa 15 % aller Gehirntumoren aus, wobei es etwa 45-50 % der bösartigen Gehirntumoren ausmacht. In Korea tritt es mit einer Rate von etwa 5 Fällen pro 100.000 Einwohner pro Jahr auf, und jährlich werden 600 bis 800 neue Patienten diagnostiziert.
Extrem niedrige Überlebensrate: Selbst wenn die derzeitige Standardbehandlung, die 'postoperative Temozolomid (Temozolomide) Chemoradiotherapie (Stupp-Protokoll)', aktiv durchgeführt wird, beträgt die durchschnittliche Überlebenszeit der Patienten (Median Overall Survival) nur 12 bis 15 Monate. Die 5-Jahres-Überlebensrate liegt unter 7-10 %, was darauf hindeutet, dass es sich um eine der schlimmsten Krebsarten handelt, die die moderne Medizin nicht besiegen konnte.
Hohe Rückfallrate: Glioblastome zeigen ein invasives Wachstumsverhalten, sodass selbst wenn der sichtbare Tumor chirurgisch entfernt wird, mikroskopisch kleine Krebszellen, die in das umgebende gesunde Hirngewebe eingedrungen sind, zurückbleiben, was dazu führt, dass über 90 % der Patienten einen Rückfall erleiden. Nach einem Rückfall gibt es keine angemessene Standardbehandlung, und die Überlebenszeit verkürzt sich auf Monate.
Die Gründe, warum die Behandlung von Glioblastomen immer wieder scheitert, sind zwei große Barrieren.
Physikalische Barriere (Blood-Brain Barrier, BBB): Die Endothelzellen der Blutgefäße im Gehirn sind durch enge Verbindungen (Tight Junctions) miteinander verbunden und blockieren über 98 % der Substanzen im Blut. Die meisten Medikamente mit einem Molekulargewicht von über 400 Dalton (Da) können diese Barriere nicht überwinden, insbesondere große Moleküle wie Antikörpertherapeutika oder Immunzellen erreichen bei systemischer Verabreichung (intravenöse Injektion) eine Durchdringungsrate von weniger als 0,1 % im Hirngewebe. Dies führt zu dem Problem des 'Lieferversagens', da selbst starke Chemotherapeutika nicht ins Gehirn geliefert werden können.
Immunologische Barriere: Glioblastome sind typische 'kalte Tumoren'. Es gibt nur wenige T-Zellen im Tumor, und die Tumorzellen sezernieren starke immununterdrückende Substanzen (wie TGF-β), die selbst die eingedrungenen Immunzellen neutralisieren. Daher haben Immun-Checkpoint-Inhibitoren (wie PD-1-Inhibitoren), die bei Melanomen oder Lungenkrebs bemerkenswerte Erfolge gezeigt haben, in der alleinigen Behandlung von Glioblastomen katastrophale Misserfolge erlitten.
Das Forschungsteam von Ahn Se-deban schlägt eine Strategie vor, die beide Barrieren gleichzeitig umgeht und angreift, nämlich einen innovativen Ansatz, bei dem 'verstärkte Immunzellen (Cell)' über einen Umweg namens 'Nase (Nose)' verabreicht werden.
Die Bemühungen der Menschheit, die Blut-Hirn-Schranke (BBB) zu überwinden, dauern seit Jahrzehnten an. Die Methode, hochdosierte Chemotherapeutika zu verabreichen, hat systemische Toxizität (Knochenmarkdepression, Leberschäden) verursacht, und die Verwendung von Mannitol, um die BBB vorübergehend zu öffnen, birgt das Risiko von Hirnödemen. In letzter Zeit wurden Technologien entwickelt, die Ultraschall verwenden, um die BBB lokal zu öffnen, aber sie erfordern immer noch Geräte und komplizierte Verfahren. Die intranasale Verabreichung, auf die das Team von Ahn Se-deban aufmerksam geworden ist, nutzt den einzigen anatomischen Zugang des menschlichen Körpers, der die äußere Umgebung direkt mit dem zentralen Nervensystem (ZNS) verbindet.
Im oberen Nasenbereich ist das olfaktorische Epithel (Olfactory Epithelium) exponiert, das olfaktorische Nervenzellen enthält. Die Axone dieser Nervenzellen sind über winzige Löcher in der Siebbeinplatte (Cribriform plate) direkt mit dem olfaktorischen Bulbus (Olfactory Bulb) des Gehirns verbunden.
Perineuraler Raum (Perineural Space): Medikamente oder Zellen können in die Nervenzellen (Intraneuronal) gelangen, aber es ist wahrscheinlicher, dass sie durch den perineuralen Raum, der die Nervenbündel umgibt, transportiert werden. Dieser Raum ist mit dem Subarachnoidalraum (Subarachnoid space) verbunden, in dem die Gehirn-Rückenmarksflüssigkeit (CSF) fließt, sodass sie, wenn sie diesen Raum durchqueren, die Blut-Hirn-Schranke umgehen und in die Gehirn-Rückenmarksflüssigkeit gelangen können.
Geschwindigkeit: Der Transport innerhalb der Nerven ist ein langsamer Prozess, der mehrere Tage dauert, während der extrazelluläre Transport durch den perineuralen Raum eine Autobahn darstellt, die innerhalb von Minuten das Gehirngewebe erreichen kann.
Wenn der olfaktorische Nerv mit dem vorderen Teil des Gehirns (nahe dem Frontallappen) verbunden ist, verbindet der weit verbreitete trigeminale Nerv (Trigeminal Nerve) die zentrale Region des Gehirns, den Hirnstamm (Brainstem) und die Brücke (Pons). Die Forschung von Ahn Se-deban zielt darauf ab, Immunzellen sowohl in den vorderen als auch in den tiefen Bereichen des Gehirns zu transportieren, indem beide Wege genutzt werden. Das Forschungsteam hat bereits vor der Auswahl für dieses nationale Projekt die Möglichkeiten durch Tierversuche überprüft. In früheren Studien wurde festgestellt, dass Immunzelltherapeutika wie CAR-T (Chimeric Antigen Receptor T-Zellen), die intranasal verabreicht wurden, effektiv in die Bereiche des Gehirntumors migrieren und signifikante antitumorale Effekte zeigen. Dies ist möglich, weil nicht nur Medikamente diffundieren, sondern lebende Zellen die Fähigkeit haben, dem Chemokin-Signal zu folgen und den Tumor aktiv zu finden, was als 'Homing' bezeichnet wird.
Die 'adoptive Zelltherapie (Adoptive Cell Therapy, ACT)' ist eine Behandlungsmethode, bei der Immunzellen aus dem Körper des Patienten extrahiert, verstärkt oder modifiziert und dann wieder injiziert werden. Das Team von Ahn Se-deban verwendet nicht einfach Immunzellen, sondern hochgradig ingenieurtechnisch entwickelte Zellen, die auf die Eigenschaften von Glioblastomen abgestimmt sind. Die kürzlich bei Blutkrebs bemerkenswert wirksamen CAR-T-Zellen sind T-Zellen, die mit Rezeptoren (CAR) ausgestattet sind, die spezifische Proteine auf der Oberfläche von Krebszellen erkennen.
Ziel: Im Fall von Glioblastomen sind EGFRvIII (ein mutiertes Protein, das in normalen Zellen nicht vorhanden ist und nur in Glioblastomen vorkommt) und IL13Rα2 die Hauptziele.
Vorteile der intranasalen Verabreichung: CAR-T-Zellen, die intravenös verabreicht werden, haben das Problem, dass sie in der Lunge oder der Leber gefangen bleiben (First-pass effect), während sie bei intranasaler Verabreichung direkt ins Gehirn gelangen können, ohne systemische Verluste, was eine hohe therapeutische Wirkung bei geringeren Dosen ermöglicht.
Professor Ahn hat sich auch auf die Forschung zu NK-Zellen (natürliche Killerzellen) und Gamma-Delta-T-Zellen konzentriert. Glioblastome können ihre Zielproteine verstecken (Antigenverlust), um den Angriff von CAR-T-Zellen zu vermeiden, während NK-Zellen als Zellen der angeborenen Immunität in der Lage sind, diese Fluchtmechanismen zu ignorieren und Krebszellen anzugreifen. Das Forschungsteam entwickelt eine Plattform, die es ermöglicht, verschiedene 'Waffen' wie CAR-T, NK und Gamma-Delta-T-Zellen je nach den Eigenschaften des Patienten über den nasalen Weg zu transportieren.
Eine der innovativsten Errungenschaften des Teams von Ahn Se-deban ist die Behandlungsmethode mit 'genetisch modifizierten Stammzellen'. Laut einer Studie, die 2025 in der internationalen Fachzeitschrift Biomedicine & Pharmacotherapy veröffentlicht wurde, hat das Forschungsteam Interleukin-12 (IL-12) Gene in mesenchymale Stammzellen (MSC) eingebracht, die eine hohe Fähigkeit zur Tumorverlagerung (Tumor-tropism) aufweisen.
Mechanismus: Intranasal oder lokal verabreichte MSC dringen tief in den Tumor ein.
Wirkung: MSC sezernieren IL-12 innerhalb des Tumors. IL-12 ist ein stark immunaktivierendes Zytokin, das schlafende NK-Zellen und T-Zellen in der Umgebung weckt und sie dazu bringt, den Tumor anzugreifen.
Ergebnisse: Bei der Kombination dieser Behandlung mit PD-1-Checkpoint-Inhibitoren wurde in einem Mausmodell eine 50 %ige vollständige Remissionsrate (Complete Remission) erreicht, und es wurde der Effekt der 'immunologischen Erinnerung (Immunological Memory)' nachgewiesen, da der Tumor nicht wieder auftrat, selbst nachdem Krebszellen nach der Behandlung erneut injiziert wurden.
Die Forschung des Teams von Ahn Se-deban ist kein isolierter Versuch, sondern steht an der Spitze des globalen Wettbewerbs um nächste Generation von Gehirntumorbehandlungstechnologien. Im Vergleich zu führenden Forschungsteams in den USA nimmt das Team des St. Mary's Hospital in Seoul eine einzigartige Position in Bezug auf die Kombination von 'Nicht-Invasivität' und 'Zellenengineering' ein.
Im Jahr 2025 veröffentlichte ein Forschungsteam der University of Pennsylvania bahnbrechende klinische Ergebnisse in Nature Medicine. Bei Patienten mit rezidivierenden Glioblastomen wurde ein 'Dual-Target CAR-T', das sowohl EGFRvIII als auch IL13Rα2 angreift, verabreicht, was zu einer Reduzierung der Tumorgröße führte.
Grenzen: Das Penn-Team bohrte ein Loch in den Schädel, um die Zellen ins Gehirn zu bringen, und setzte einen Schlauch namens 'Ommaya-Reservoir' ein, um sie direkt in die Ventrikel zu injizieren. Dies ist eine sichere Methode, erfordert jedoch eine Operation, birgt das Risiko einer Infektion und verursacht große Schmerzen für die Patienten.
Vergleich: Die intranasale Verabreichungsmethode des Ahn-Teams hat das Potenzial, ein 'Game Changer' zu sein, der ähnliche Effekte ohne chirurgische Eingriffe erzielen kann.
Ein Forschungsteam der University of Washington veröffentlichte 2025 in PNAS Ergebnisse zur Behandlung von Glioblastomen durch die Verabreichung von Nanopartikeln namens 'sphärische Nukleinsäuren (Spherical Nucleic Acids)' über die Nase.
Ansatz: Goldnanopartikel wurden mit immunaktiven Substanzen beschichtet und intranasal verabreicht, um die Immunumgebung des Gehirntumors zu aktivieren.
Vergleich: Die Methode von WashU konzentriert sich auf die 'Medikamenten (Nanopartikel)'-Verabreichung, während das Ahn-Team 'Zellen (Cell)' transportiert. Zellen sind im Gegensatz zu Medikamenten lebende Therapeutika, die sich selbst bewegen, vermehren und auf Veränderungen im Tumor reagieren können, was sie möglicherweise besser geeignet macht, die komplexe Mikroumgebung von Glioblastomen zu überwinden.
Diese Forschung, die mit Unterstützung des Ministeriums für Wissenschaft und Technologie (300 Millionen Won über 3 Jahre) durchgeführt wird, konzentriert sich darauf, konkrete Daten für die klinische Anwendung über grundlegende Experimente hinaus zu sichern.
Wegkartierung (Mapping): Durch die Verwendung von fluoreszenzmarkierten Immunzellen wird visuell ermittelt, welchen Weg die Zellen bei intranasaler Verabreichung hauptsächlich über den olfaktorischen Nerv und den trigeminalen Nerv nutzen und in welchen Bereichen des Gehirns sie sich ansammeln.
Zellenengineering: Es werden Technologien integriert, um Proteine zu überexprimieren, die Immunzellen helfen, sich gut an die Nervenschleimhaut anzulagern oder sich schneller im perineuralen Raum zu bewegen. Dies soll verhindern, dass die Zellen durch Nasenausfluss oder Niesen ausgeschieden werden und die Effizienz des Transports ins Gehirn maximiert werden.
Sicherheits- und Toxizitätsbewertung: Es wird überprüft, ob die Immunzellen, die das Gehirn erreichen, keine neurotoxischen (Neurotoxizität) oder übermäßigen Entzündungsreaktionen gegen normale Gehirnzellen auslösen.
Professor Ahn erklärte in einem Interview: "Wenn diese Forschung etabliert wird, könnte sie sich zu einer 'universellen Plattform' entwickeln, die nicht nur für Glioblastome, sondern auch für andere Erkrankungen des zentralen Nervensystems wie Hirnmetastasen, Alzheimer und Parkinson anwendbar ist. Die Technologie, die es ermöglicht, 'Zellen' nicht-operativ ins Gehirn zu bringen, könnte auch bei degenerativen Hirnerkrankungen zur Regeneration von Nerven durch die Verabreichung von Stammzellen angewendet werden.
Glioblastome waren in den letzten Jahrzehnten das Grab vieler neuer Medikamente. Die Blut-Hirn-Schranke, eine uneinnehmbare Festung, und die immunologischen Eigenschaften als kalte Tumoren haben bestehende Chemotherapie-Strategien untergraben. Doch die 'intranasale Verabreichung basierte adoptive Immunzelltherapie' des Teams von Ahn Se-deban wird als innovativer Durchbruch angesehen, um diesen Stillstand zu überwinden.
Wenn diese Forschung erfolgreich durchgeführt wird, wird sich folgende Zukunft eröffnen.
Verbesserung der Lebensqualität der Patienten: Patienten könnten Immunzelltherapien in Form von Nasensprays oder Tropfen ambulant erhalten, ohne wiederholte Kraniotomien oder Krankenhausaufenthalte, was ihre Schmerzen erheblich lindern würde.
Steigerung der Therapieeffizienz: Durch die direkte Ansprache von hochkonzentrierten Immunzellen im Bereich des Gehirntumors ohne systemische Nebenwirkungen, die bei intravenöser Verabreichung auftreten, könnte die therapeutische Wirkung maximiert werden.
Prävention von Rückfällen: Durch die Bildung immunologischer Erinnerungen könnte die Möglichkeit eröffnet werden, das größte Problem von Glioblastomen, die Rückfälle, grundlegend zu verhindern.
Die Forschung von Professor Ahn ist nicht nur die Entwicklung neuer Medikamente, sondern ein integrativer Ansatz, der den 'Weg' der Medikamentenverabreichung innoviert und 'Zellen' entwirft, die für diesen Weg optimiert sind. Die dreijährige Forschungsperiode, die 2026 beginnt, wird ein entscheidender Wendepunkt sein, an dem Korea als 'First Mover' im Bereich der Neuroonkologie weltweit aufsteigen kann. Wir sind jetzt Zeugen eines historischen Wendepunkts, an dem Glioblastome, die als unheilbar galten, sich in 'kontrollierbare chronische Krankheiten' oder 'heilbare Krankheiten' verwandeln.

