İnsanın beyni, biyolojik olarak en karmaşık şekilde korunan organ olmasının yanı sıra, paradoksal olarak bu koruma mekanizması nedeniyle tedavi edilmesi en zor olan 'geçilemez kale' olarak kalmaktadır. Bunlar arasında glioblastoma (Glioblastoma, GBM), nöroşirürji alanında en ölümcül ve yıkıcı malign tümör olarak sınıflandırılmaktadır. 2 Şubat 2026'da, Katolik Üniversitesi Seul St. Mary Hastanesi Nöroşirürji Prof. Ansdevan ekibi, Bilim ve Teknoloji Bakanlığı'nın 'Yeni Araştırma - Keşif Araştırması' projesine seçilerek 'Burun İçi Uygulama Tabanlı Adaptif Bağışıklık Hücresi Tedavisi' araştırmasına başlamıştır. Bu, glioblastoma tedavisinin tarihsel zorluklarını aşmak için cesur bir meydan okumadır.
Glioblastoma, yetişkinlerde meydana gelen en yaygın primer malign beyin tümörüdür ve tüm beyin tümörlerinin yaklaşık %15'ini oluşturmaktadır. Malign beyin tümörleri arasında ise yaklaşık %45-50'ye ulaşmaktadır. Ülkede, yılda 100.000 kişide yaklaşık 5 kişi oranında görülmekte ve her yıl 600-800 yeni hasta teşhis edilmektedir.
Aşırı Düşük Hayatta Kalma Oranı: Mevcut standart tedavi yöntemi olan 'ameliyat sonrası temozolomide (Temozolomide) kemoterapi ve radyoterapi kombinasyonu (Stupp Protokolü)' aktif olarak uygulansa bile, hastaların ortalama hayatta kalma süresi (Median Overall Survival) sadece 12-15 ay ile sınırlıdır. 5 yıllık hayatta kalma oranı %7-10'un altındadır ve bu, pankreas kanseri ile birlikte modern tıbbın fethedemediği en kötü kanser türlerinden biri olduğunu göstermektedir.
Yüksek Nüks Oranı: Glioblastoma, invaziv bir büyüme modeli sergilediği için, cerrahi ile görünür tümör tamamen çıkarılsa bile, çevredeki normal beyin dokusuna sızmış mikroskobik kanser hücreleri kalmaktadır ve %90'dan fazla hasta nüks yaşamaktadır. Nüks sonrası uygun bir standart tedavi yöntemi yoktur ve hayatta kalma süresi birkaç ay ile kısıtlanmaktadır.
Glioblastoma tedavisinin başarısız olmasının nedenleri, iki büyük engelden kaynaklanmaktadır.
Fiziksel Engeller (Kan-Beyin Bariyeri, BBB): Beyin damar endotel hücreleri, sıkı bağlantılar (Tight Junction) ile birbirine bağlıdır ve kan içindeki maddelerin %98'inden fazlasını engellemektedir. Molekül ağırlığı 400 dalton (Da) üzerinde olan çoğu ilaç bu bariyeri geçemez ve özellikle antikor tedavileri veya bağışıklık hücreleri gibi büyük moleküller, sistemik uygulama (damar içi enjeksiyon) sırasında beyin parankimine ulaşma oranı %0.1'in altında kalmaktadır. Bu, güçlü kemoterapilerin geliştirilse bile beyin içine ulaştırılamaması nedeniyle 'dağıtım başarısızlığı' sorununu ortaya çıkarmaktadır.
Bağışıklık Engeli (İmmünolojik Engeller): Glioblastoma, tipik bir 'soğuk tümör (Cold Tumor)' olarak bilinir. T hücrelerinin tümör içine girişi azdır ve tümör hücreleri güçlü bağışıklık baskılayıcı maddeler (TGF-β vb.) salgılayarak içeri giren bağışıklık hücrelerini etkisiz hale getirir. Bu nedenle, melanom veya akciğer kanserinde mucizevi etkiler gösteren immün kontrol noktası inhibitörleri (PD-1 inhibitörleri vb.) glioblastoma tek başına tedavisinde büyük başarısızlıklar yaşamıştır.
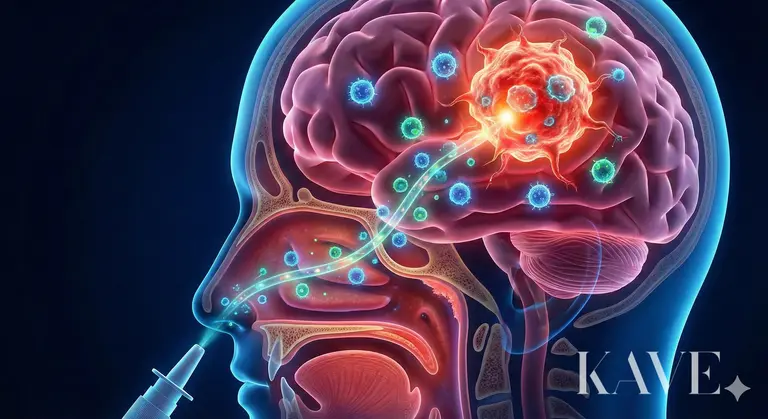
Prof. Ansdevan ekibinin araştırması, bu iki engeli aynı anda aşmayı ve hedef almayı amaçlayan bir strateji sunmaktadır, yani 'burun (Nose)' adlı bir alternatif yol ile 'güçlendirilmiş bağışıklık hücrelerini (Cell)' enjekte etme yenilikçi yaklaşımıdır.
Kan-beyin bariyerini (BBB) aşmak için insanlığın çabaları onlarca yıl boyunca devam etmiştir. Yüksek doz kemoterapilerin uygulanması sistemik toksisite (kemik iliği baskılanması, karaciğer toksisitesi) yaratmış ve mannitol kullanarak BBB'yi geçici olarak açma yöntemi beyin ödemi riski taşımıştır. Son zamanlarda, ultrason kullanarak lokal olarak BBB'yi açma teknikleri denenmektedir, ancak hala ekipman gerekmekte ve karmaşık prosedürlerden geçilmesi gerekmektedir. Prof. Ansdevan ekibinin dikkatini çektiği burun içi uygulama (Intranasal delivery), dış ortam ile merkezi sinir sistemi (CNS) arasında doğrudan bağlantı sağlayan insan vücudundaki tek anatomik yoldur.
Burun üst kısmındaki koku epitelinde (Olfactory Epithelium) koku sinir hücreleri bulunmaktadır. Bu sinir hücrelerinin aksonları (Axon), cribriform plate'in ince deliklerinden geçerek doğrudan beynin koku bulbusuna (Olfactory Bulb) bağlanmaktadır.
Sinir Çevresi Alanı (Perineural Space): İlaç veya hücreler sinir hücrelerinin içine (Intraneuronal) geçebilir, ancak bunun yerine sinir demetini saran sinir çevresi alanı (Perineural space) üzerinden geçme olasılığı daha yüksektir. Bu alan, beyin omurilik sıvısının (CSF) aktığı subaraknoid alan (Subarachnoid space) ile devamlılık gösterir, bu alandan geçildiğinde kan-beyin bariyerini aşmadan beyin omurilik sıvısına girebilir.
Hız: Sinir içi taşınma, günler süren yavaş bir süreçken, sinir çevresi alanı üzerinden hücre dışı taşınma (Extracellular transport) birkaç dakika içinde beyin dokusuna ulaşabilir.
Koku siniri, beynin ön kısmına (frontal lob bölgesi) bağlanıyorsa, burun mukozası boyunca geniş bir şekilde dağılan trigeminal sinir (Trigeminal Nerve) beyin sapı (Brainstem) ve pons bölgesine bağlanmaktadır. Prof. Ansdevan'ın araştırması, bu iki yolu da kullanarak, beynin ön kısmının yanı sıra derinlerde bulunan tümörlere de bağışıklık hücrelerini ulaştırmayı hedeflemektedir. Araştırma ekibi, bu ulusal proje seçimi öncesinde zaten hayvan deneyleri ile olasılığı doğrulamıştır. Önceki çalışmalarda CAR-T (Chimeric Antigen Receptor T-cell) gibi bağışıklık hücre tedavileri burun yoluyla uygulandığında, bu hücrelerin beyin tümörü bölgesine etkili bir şekilde göç ettiği (Migration) ve anlamlı antitümör etkisi gösterdiği tespit edilmiştir. Bu, sadece ilaçların yayılması değil, canlı hücrelerin kemokin (Chemokine) sinyallerini takip ederek tümörü aktif bir şekilde bulma 'homing' yeteneğini kullanarak mümkün olmuştur.
'Adaptif Bağışıklık Hücresi Tedavisi (Adoptive Cell Therapy, ACT)' hastanın vücudundan bağışıklık hücrelerini çıkarıp güçlendirdikten sonra yeniden enjekte etme tedavisidir. Prof. Ansdevan ekibi, basit bağışıklık hücreleri yerine glioblastomanın özelliklerine uygun olarak yüksek derecede mühendislik yapılmış hücreler kullanmaktadır. Son zamanlarda kanserli kan hastalıklarında mucizevi etkiler gösteren CAR-T hücreleri, kanser hücrelerinin yüzeyindeki belirli proteinleri tanıyan reseptörleri (CAR) T hücrelerine entegre edilmiştir.
Hedef: Glioblastoma durumunda EGFRvIII (normal hücrelerde bulunmayan ve glioblastomada bulunan mutasyona uğramış protein) veya IL13Rα2 ana hedef olmaktadır.
Burun İçi Uygulamanın Avantajları: Damar yoluyla uygulanan CAR-T hücreleri akciğer veya karaciğerde sıkışma (First-pass effect) sorunuyla karşılaşırken, burun içi uygulamada bu sistemik kayıplar olmadan doğrudan beyne ulaşabilmekte ve daha düşük dozlarla yüksek tedavi etkisi beklenebilmektedir.
Prof. Ansdevan, T hücrelerinin yanı sıra NK hücreleri (doğal öldürücü hücreler) ve gamma delta T hücreleri üzerine de yoğunlaşmıştır. Glioblastoma, kendi hedef proteinlerini gizleyerek (Antigen Loss) CAR-T hücrelerinin saldırısından kaçabilmektedir, ancak NK hücreleri bu kaçış mekanizmalarını göz ardı ederek kanser hücrelerini hedef alabilen doğuştan bağışıklık hücreleridir. Araştırma ekibi, hastanın özelliklerine göre CAR-T, NK, gamma delta T hücreleri gibi çeşitli 'silahları' burun yolu ile taşıyabilecek bir platform inşa etmektedir.
Prof. Ansdevan ekibinin en özgün başarılarından biri 'genetik olarak modifiye edilmiş kök hücreler' kullanarak geliştirdikleri tedavi yöntemidir. 2025 yılında uluslararası dergi Biomedicine & Pharmacotherapy'de yayımlanan araştırmaya göre, araştırma ekibi tümörü hedef alma yeteneği (Tumor-tropism) yüksek olan mezenkimal kök hücreleri (MSC) üzerinde interlökin-12 (IL-12) genini taşıyan bir tedavi geliştirmiştir.
Mekanizma: Burun veya lokal olarak uygulanan MSC'ler tümör derinliklerine nüfuz etmektedir.
Etki: MSC'ler tümör içinde IL-12 salgılamaktadır. IL-12, güçlü bir bağışıklık aktive edici sitokin olup, çevredeki uyku halindeki NK hücreleri ve T hücrelerini uyandırarak tümörü hedef almasını sağlamaktadır.
Sonuç: Bu tedavi yöntemi PD-1 immün kontrol noktası inhibitörü ile kombinlendiğinde, fare modellerinde %50 tam remisyon (Complete Remission) oranı göstermiş ve tedavi tamamlandıktan sonra kanser hücreleri yeniden enjekte edilse bile nüks etmeyen 'bağışıklık hafızası (Immunological Memory)' etkisi kanıtlanmıştır.
Prof. Ansdevan ekibinin araştırması, izole bir çaba değil, dünya genelinde yeni nesil beyin tümörü tedavi teknolojileri yarışının ön saflarında yer almaktadır. ABD'deki önde gelen araştırma ekipleri ile karşılaştırıldığında, Seul St. Mary Hastanesi ekibinin yaklaşımı 'minimal invazivlik' ve 'hücre mühendisliği' kombinasyonu açısından benzersiz bir konumda bulunmaktadır.
2025 yılında, Pennsylvania Üniversitesi araştırmacıları Nature Medicine'de çığır açan klinik sonuçları yayımlamıştır. Nüks eden glioblastoma hastalarına EGFRvIII ve IL13Rα2'yi aynı anda hedef alan 'çift hedef (Dual-Target) CAR-T' uygulayarak tümör boyutunu küçültmeyi başarmışlardır.
Sınırlamalar: Penn ekibi, hücreleri beyne göndermek için kafatasında delikler açarak 'Ommaya rezervuarı (Ommaya reservoir)' adı verilen bir tüp yerleştirip beyin ventrikülüne doğrudan enjekte etmiştir. Bu kesin bir iletim yöntemi olsa da, cerrahi gerektirmekte ve enfeksiyon riski taşımakta, hastaya büyük acı vermektedir.
Karşılaştırma: Prof. Ansdevan ekibinin burun içi uygulama yöntemi, bu tür cerrahi işlemler olmadan benzer etkiler yaratma potansiyeline sahip bir 'Oyun Değiştirici' olabilir.
Washington Üniversitesi araştırma ekibi, 2025 yılında PNAS'da burun yoluyla 'sferik nükleik asitler (Spherical Nucleic Acids)' adlı nano parçacıkları uygulayarak glioblastoma tedavi ettiklerini duyurmuştur.
Yaklaşım: Altın nano parçacıkların bağışıklık aktive edici maddelerle kaplanarak burun yoluyla uygulanması, beyin tümörünün bağışıklık ortamını aktive etmiştir.
Karşılaştırma: WashU'nun yöntemi 'ilaç (nano parçacık)' iletimine odaklanırken, Prof. Ansdevan ekibi 'hücre (Cell)' iletimine odaklanmaktadır. Hücreler, ilaçlardan farklı olarak kendiliğinden hareket edebilir, çoğalabilir ve tümör değişikliklerine yanıt verebilir, bu nedenle karmaşık glioblastoma mikro ortamını aşmada daha avantajlı olabilir.
Bilim ve Teknoloji Bakanlığı'nın desteği (3 yıl boyunca 300 milyon won) ile yürütülen bu araştırma, temel deneylerin ötesine geçerek klinik uygulama için somut veriler elde etmeye odaklanmaktadır.
Yol Haritalama (Mapping): Florasan işaretli bağışıklık hücreleri kullanarak burun içi uygulama sırasında hücrelerin koku siniri ve trigeminal sinir arasında hangi yolu kullandığını ve beynin hangi bölgelerinde ne kadar biriktiğini görsel olarak belirleyecektir.
Hücre Mühendisliği: Bağışıklık hücrelerinin yüzeyine sinir mukozasına iyi yapışan veya sinir çevresi alanında daha hızlı hareket etmelerini sağlayan proteinleri (örneğin: kemokin reseptörü CXCR4 vb.) aşırı ifade eden teknikler entegre edilecektir. Bu, hücrelerin burun akıntısı veya hapşırma nedeniyle dışarı atılmasını önlemek ve beyne geçiş verimliliğini maksimize etmek içindir.
Güvenlik ve Toksisite Değerlendirmesi: Beyne ulaşan bağışıklık hücrelerinin normal beyin hücrelerine saldırarak sinir toksisitesi (Neurotoxicity) veya aşırı iltihaplanma tepkileri oluşturup oluşturmadığını doğrulamak.
Prof. Ansdevan, bir röportajda "Bu araştırma kurulduğunda, sadece glioblastoma değil, beyin metastazı (Brain Metastasis) veya Alzheimer, Parkinson hastalığı gibi diğer merkezi sinir sistemi hastalıklarına da uygulanabilir bir 'evrensel platform' haline gelebilir" dedi. İlaç değil 'hücre'yi cerrahi olmayan bir şekilde beyne gönderen bu teknoloji, dejeneratif beyin hastalıklarında kök hücreleri ile sinirleri yeniden canlandırmak için de aynı şekilde uygulanabilir.
Glioblastoma, son birkaç on yılda birçok yeni ilacın mezarı olmuştur. Kan-beyin bariyeri gibi demirden bir kale ve soğuk tümör gibi immünolojik özellikler, mevcut kemoterapi stratejilerini etkisiz hale getirmiştir. Ancak Seul St. Mary Hastanesi'nden Prof. Ansdevan ekibinin 'burun içi uygulama tabanlı adaptif bağışıklık hücresi tedavisi', bu çıkmazı aşmak için yenilikçi bir çözüm olarak değerlendirilmektedir.
Bu araştırma başarılı bir şekilde gerçekleştirilirse, aşağıdaki gibi bir gelecek açılacaktır.
Hastaların Yaşam Kalitesinin Artması: Tekrarlayan kraniyotomi veya hastaneye yatış olmaksızın, ayakta tedavi ile burun spreyi veya damla şeklinde bağışıklık hücresi tedavisi alabilme imkanı, hastaların acısını önemli ölçüde azaltacaktır.
Tedavi Verimliliğinin Artması: Damar yoluyla uygulama sırasında ortaya çıkan sistemik yan etkiler olmaksızın, beyin tümörü bölgesine yüksek yoğunlukta bağışıklık hücreleri doğrudan hedeflenerek tedavi etkisi maksimize edilebilecektir.
Nüksün Önlenmesi: Bağışıklık hafızası oluşturularak glioblastomanın en büyük sorunu olan nüksün kökünden engellenmesi olasılığı açılmaktadır.
Prof. Ansdevan'ın araştırması, sadece yeni ilaçlar geliştirmekle kalmayıp, ilaçları ileten 'yolu' yenilikçi bir şekilde tasarlamakta ve bu yola optimize edilmiş 'hücreleri' tasarlamaktadır. 2026'dan itibaren başlayacak 3 yıllık araştırma dönemi, Kore'nin dünya nöroonkoloji alanında 'ilk hareket eden' (First Mover) olarak sıçrama yapabileceği önemli bir dönüm noktası olacaktır. Şu anda, tedavi edilemez hastalık olarak adlandırılan glioblastomanın 'yönetilebilir kronik hastalık' veya 'tamamen iyileştirilebilir hastalık' haline gelmesinin tarihi bir dönüm noktasını gözlemliyoruz.

