Menneskehjernen er biologisk det mest sofistikerte beskyttede organet, og paradoksalt nok, på grunn av denne beskyttelsesmekanismen, forblir det en 'uinntagelig festning' som er vanskelig å behandle. Blant dem er glioblastom (Glioblastoma, GBM) klassifisert som den mest dødelige og destruktive maligne svulsten innen nevrokirurgi. Den 2. februar 2026 ble professor Ansdevan team ved Seoul St. Mary's Hospital valgt til prosjektet 'Ny forskning - Pionerforskning' av Ministeriet for vitenskap og teknologi, og startet forskningen på 'Intranasal Levering av Adoptiv Immunterapi', som er en dristig utfordring for å løse den historiske utfordringen med behandling av glioblastom.
Glioblastom er den vanligste primære maligne hjernesvulsten som oppstår hos voksne, og utgjør omtrent 15% av alle hjernesvulster, og omtrent 45-50% av maligne hjernesvulster. I Sør-Korea oppstår det omtrent 5 personer per 100 000 innbyggere årlig, med 600-800 nye pasienter diagnostisert hvert år.
Ekstremt lav overlevelsesrate: Selv med aktiv implementering av den nåværende standardbehandlingen, 'postoperativ Temozolomid (Temozolomide) kjemoterapi og strålebehandling (Stupp-protokoll)', er den gjennomsnittlige overlevelsesperioden (Median Overall Survival) bare 12-15 måneder. 5-års overlevelsesrate er under 7-10%, noe som indikerer at det er en av de verste kreftformene som moderne medisin ikke har erobret.
Høy tilbakefallsrate: Glioblastom viser et invasivt vekstmønster, så selv om synlige svulster fjernes kirurgisk, forblir mikroskopiske kreftceller som har infiltrert det omkringliggende normale hjernevevet, og mer enn 90% av pasientene opplever tilbakefall. Etter tilbakefall finnes det ingen passende standardbehandling, og overlevelsesperioden forkortes til flere måneder.
Årsakene til at behandlingen av glioblastom mislykkes, skyldes i stor grad to enorme barrierer.
Fysisk barriere (Blood-Brain Barrier, BBB): Hjerneblodkarens endotelceller er koblet sammen med tette forbindelser (Tight Junction), som blokkerer mer enn 98% av stoffene i blodet. De fleste legemidler med en molekylvekt på over 400 dalton (Da) kan ikke passere denne barrieren, og spesielt store molekyler som antistoffbehandlinger eller immunceller har en hjernevev nådd rate på mindre enn 0,1% ved systemisk administrering (intravenøs injeksjon). Dette fører til et 'leveringsfeil' problem, selv om kraftige kreftmidler utvikles.
Immunologisk barriere: Glioblastom er en typisk 'kald svulst'. Det er lite infiltrering av T-celler i svulsten, og svulstcellene skiller ut kraftige immunhemmende stoffer (som TGF-β) som lammer de infiltrerte immuncellene. Som et resultat har immuncheckpoint-hemmere (som PD-1-hemmere) som har vist mirakuløse effekter i melanom og lungekreft, opplevd katastrofale feil i enslig behandling av glioblastom.
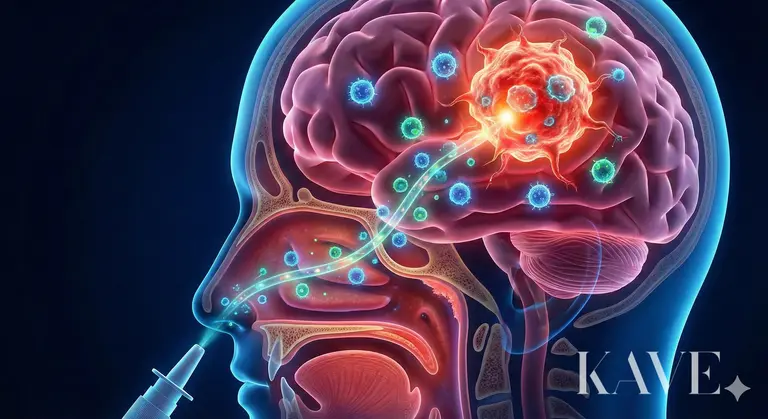
Professor Ansdevan teamets forskning presenterer en innovativ tilnærming som omgår og angriper disse to barrierene samtidig, nemlig 'Nese (Nose)' som en omkjøring for å injisere 'forsterkede immunceller (Cell)' .
Menneskehetens innsats for å overvinne blod-hjerne-barrieren (BBB) har pågått i flere tiår. Metoden med å pumpe inn høye doser av kreftmidler har ført til systemisk toksisitet (benmarghemming, leverskade), og metoden med å bruke mannitol for midlertidig å åpne BBB har medført risiko for hjerneødem. Nylig har teknologier som bruker ultralyd for lokalt å åpne BBB blitt forsøkt, men det krever fortsatt utstyr og kompliserte prosedyrer. Professor Ansdevan teamets fokus på intranasal levering (Intranasal delivery) utnytter den eneste anatomiske passasjen i menneskekroppen som direkte forbinder det ytre miljøet med sentralnervesystemet (CNS).
Den olfaktoriske epitelet i den øvre nesegang (Olfactory Epithelium) har eksponerte olfaktoriske nerveceller. Aksjonen til disse nervecellene (Axon) er direkte koblet til hjerneområdet for lukt (Olfactory Bulb) gjennom små hull i cribriformplaten (Cribriform plate).
Perineural rom (Perineural Space): Legemidler eller celler kan bevege seg inn i nervecellene (Intraneuronal), men det er mer sannsynlig at de beveger seg gjennom det perineurale rommet som omgir nervebuntene. Dette rommet er kontinuerlig med det subaraknoidale rommet (Subarachnoid space) der cerebrospinalvæsken (CSF) strømmer, og ved å passere gjennom dette kan de komme inn i cerebrospinalvæsken uten å gå gjennom blod-hjerne-barrieren.
Hastighet: Transport inne i nervene er en langsom prosess som tar flere dager, mens ekstracellulær transport gjennom det perineurale rommet kan fungere som en motorvei som når hjernevevet på bare noen få minutter.
Hvis de olfaktoriske nervene kobles til den fremre delen av hjernen (nær frontallappen), kobles den trigeminale nerven (Trigeminal Nerve) som er bredt distribuert over neseslimhinnen, til hjernens sentrum, hjernestammen (Brainstem) og pons. Professor Ansdevans forskning har som mål å bruke begge disse banene for å levere immunceller til svulster som ligger dypt i hjernen, så vel som til den fremre delen av hjernen. Forskningsgruppen har allerede bekreftet muligheten gjennom dyreforsøk før denne nasjonale prosjektutvelgelsen. I tidligere studier ble det bekreftet at når immuncellebehandlinger som CAR-T (Chimeric Antigen Receptor T-celler) ble administrert intranasalt, migrerte disse cellene effektivt til hjernesvulstområdet og viste signifikante antitumoreffekter. Dette er mulig fordi det ikke bare er legemidler som sprer seg, men levende celler som aktivt finner svulsten ved å følge kjemokinsignaler (Chemokine) ved hjelp av 'homing' evnen.
'Adoptiv Immunterapi (Adoptive Cell Therapy, ACT)' er en behandlingsmetode der immunceller blir ekstrahert fra pasientens kropp, forsterket/modifisert og deretter injisert på nytt. Professor Ansdevan teamet bruker ikke bare enkle immunceller, men høyt ingeniørte celler tilpasset egenskapene til glioblastom. Nylig har CAR-T celler, som har vist mirakuløse effekter i blodkreft, fått festet reseptorer (CAR) som gjenkjenner spesifikke proteiner på overflaten av kreftceller til T-cellene.
Mål: For glioblastom er EGFRvIII (et mutert protein som ikke finnes i normale celler, men kun i glioblastom) og IL13Rα2 de viktigste målene.
Fordeler med intranasal levering: CAR-T celler administrert intravenøst har problemer med å bli fanget i lungene eller leveren (First-pass effect), men ved intranasal levering kan de gå direkte til hjernen uten systemisk tap, noe som gir høyere terapeutisk effekt selv med lavere doser.
Professor Ansdevan har også fokusert på forskning på NK-celler (naturlige drepeceller) og gamma-delta T-celler. Glioblastom kan skjule sine målproteiner (Antigen Loss) for å unngå angrep fra CAR-T celler, men NK-celler er medfødte immunceller som kan angripe kreftceller uavhengig av disse unngåelsesmekanismene. Forskningsgruppen bygger en plattform som kan transportere ulike 'våpen' som CAR-T, NK, gamma-delta T-celler gjennom nesepassasjen, avhengig av pasientens egenskaper.
En av professor Ansdevan teamets mest originale prestasjoner er behandlingsmetoden som bruker 'genmodifiserte stamceller'. Ifølge en studie publisert i det internasjonale tidsskriftet Biomedicine & Pharmacotherapy i 2025, har forskningsgruppen utstyrt mesenkymale stamceller (MSC) med interleukin-12 (IL-12) genet, som har en utmerket evne til å finne svulster (Tumor-tropism).
Mekanisme: MSC som er administrert intranasalt eller lokalt infiltrerer dypt inn i svulsten.
Virkningsmekanisme: MSC skiller ut IL-12 inne i svulsten. IL-12 er en kraftig immunaktiverende cytokin som vekker sovende NK-celler og T-celler i nærheten til å angripe svulsten.
Resultater: Når denne behandlingen ble kombinert med PD-1 immuncheckpoint-hemmere, viste den en 50% fullstendig remisjon (Complete Remission) rate i musemodeller, og beviste til og med 'immunologisk hukommelse' effekten, der kreftcellene ikke tilbakekom selv etter at de ble injisert på nytt etter behandlingen.
Professor Ansdevan teamets forskning er ikke en isolert innsats, men er i frontlinjen av den globale konkurransen om neste generasjons hjernesvulstbehandlingsteknologi. Sammenlignet med ledende forskerteam i USA, har Seoul St. Mary's Hospital teamets tilnærming en unik posisjon når det gjelder kombinasjonen av 'ikke-invasiv' og 'celleingeniør'.
I 2025 publiserte forskere fra University of Pennsylvania banebrytende kliniske resultater i Nature Medicine. De administrerte 'dual-target (Dual-Target) CAR-T' som angriper både EGFRvIII og IL13Rα2 til pasienter med tilbakefallende glioblastom, og lyktes i å redusere svulststørrelsen.
Begrensninger: Penn-teamet måtte bore hull i kraniet for å sende cellene til hjernen og sette inn et rør kalt 'Ommaya reservoir' for direkte injeksjon i ventriklene. Dette er en sikker leveringsmetode, men krever kirurgi, med infeksjonsrisiko og gir stor smerte for pasienten.
Sammenligning: Ansdevan-teamets intranasale leveringsmetode har potensial til å være en 'Game Changer' som kan oppnå lignende effekter uten slike kirurgiske inngrep.
Forskere fra University of Washington publiserte i 2025 i PNAS resultater av behandling av glioblastom ved å administrere nanokorn kalt 'spherical nucleic acids' intranasalt.
Tilnærming: Immunaktiverende stoffer ble belagt på gullnanopartikler og administrert intranasalt for å aktivere immunmiljøet i hjernesvulsten.
Sammenligning: WashUs metode fokuserer på 'legemiddel (nanopartikler)' levering, mens Ansdevan-teamet leverer 'celler (Cell)'. Celler, i motsetning til legemidler, kan bevege seg selv, formere seg og reagere på endringer i svulsten, noe som kan være mer fordelaktig for å overvinne det komplekse mikromiljøet av glioblastom.
Denne forskningen, støttet av Ministeriet for vitenskap og teknologi (300 millioner KRW over 3 år), fokuserer på å skaffe konkrete data for klinisk anvendelse utover grunnleggende eksperimenter.
Rute kartlegging (Mapping): Ved å bruke fluorescerende merkede immunceller, vil det visuelle kartlegge hvilken rute cellene hovedsakelig bruker når de administreres intranasalt, og hvor mye de akkumuleres i hvilke deler av hjernen.
Celleingeniør: Teknologier som overuttrykker proteiner (f.eks. kjemokinreseptor CXCR4) på overflaten av immuncellene for å hjelpe dem med å feste seg godt til nerveepitelet eller bevege seg raskere gjennom det perineurale rommet, vil bli integrert. Dette er for å hindre at cellene blir utvist på grunn av rennende nese eller nysing, og for å maksimere effektiviteten av bevegelsen til hjernen.
Sikkerhets- og toksisitetsvurdering: Det vil bli verifisert om immuncellene som når hjernen forårsaker nevrotoksisitet (Neurotoxicity) ved å angripe normale hjerneceller eller forårsake overdrevne inflammatoriske reaksjoner.
Professor Ansdevan uttalte i et intervju: "Når denne forskningen er etablert, kan den utvikle seg til en 'universell plattform' som kan brukes ikke bare for glioblastom, men også for andre sentralnervesykdommer som hjerne metastaser, Alzheimers og Parkinsons sykdom. Teknologien for å sende 'celler' ikke-kirurgisk til hjernen kan også brukes til å levere stamceller for å regenerere nerver i degenerative hjernesykdommer."
Glioblastom har vært graven for utallige nye legemidler de siste tiårene. Den blod-hjerne-barrieren som en jernfestning og de immunologiske egenskapene til kalde svulster har svekket eksisterende kreftstrategier. Imidlertid vurderes professor Ansdevan teamets 'intranasal levering av adoptiv immunterapi' som en innovativ løsning for å bryte denne fastlåste situasjonen.
Hvis denne forskningen lykkes, vil fremtiden se slik ut:
Forbedring av pasientens livskvalitet: Uten gjentatte kraniotomier eller sykehusinnleggelser, vil pasientene kunne motta immuncellebehandling i poliklinisk setting gjennom nesespray eller dråpeform, noe som vil redusere pasientens lidelse betydelig.
Økt behandlingseffektivitet: Ved å direkte angripe hjernesvulstområdet med høy konsentrasjon av immunceller uten systemiske bivirkninger som oppstår ved intravenøs administrering, kan behandlingseffekten maksimeres.
Forebygging av tilbakefall: Gjennom dannelse av immunhukommelse åpnes muligheten for å blokkere tilbakefall, som er det største problemet med glioblastom, fra kilden.
Professor Ansdevans forskning er ikke bare å utvikle nye legemidler, men en fusjonert tilnærming som innovativt endrer 'ruten' for legemiddellevering og designer 'celler' optimalisert for den ruten. Den treårige forskningsperioden som begynner i 2026 vil være et viktig vendepunkt for Sør-Korea til å bli 'First Mover' innen det globale feltet for nevro-onkologi. Vi er nå vitne til et historisk vendepunkt der glioblastom, som tidligere ble ansett som en uhelbredelig sykdom, kan bli en 'håndterbar kronisk sykdom' eller en 'kurbar sykdom'.

