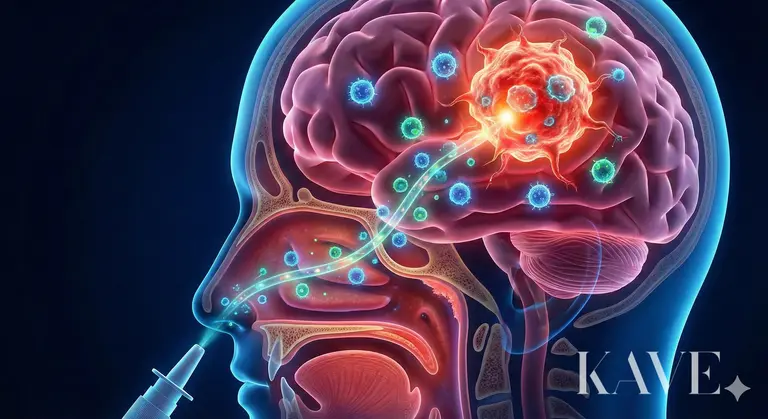
Le cerveau humain est biologiquement l'organe le plus finement protégé et, paradoxalement, en raison de ce mécanisme de protection, il reste la "forteresse imprenable" la plus difficile à traiter. Parmi ceux-ci, le glioblastome (Glioblastome, GBM) est classé comme la tumeur maligne la plus mortelle et destructrice dans le domaine de la neurochirurgie. Le 2 février 2026, l'équipe du professeur Stephen Ahn du département de neurochirurgie de l'hôpital St. Mary de l'Université catholique de Séoul a été sélectionnée pour le projet "Recherche de jeunes chercheurs - Recherche pionnière" du ministère des Sciences et des Technologies de l'information et de la communication, lançant une recherche sur le "traitement par cellules immunitaires adoptives basé sur l'administration intranasale", un défi audacieux pour résoudre le problème historique du traitement du glioblastome.
Le glioblastome est la tumeur cérébrale maligne primaire la plus courante chez les adultes, représentant environ 15 % de toutes les tumeurs cérébrales et environ 45 à 50 % des tumeurs cérébrales malignes. En Corée, il se produit à un taux d'environ 5 cas pour 100 000 personnes par an, avec 600 à 800 nouveaux patients diagnostiqués chaque année.
Taux de survie extrêmement bas : Même en appliquant activement le traitement standard actuel, la "thérapie combinée de radiothérapie et de temozolomide (Stupp Protocol)" après la chirurgie, la durée de survie médiane des patients n'est que de 12 à 15 mois. Le taux de survie à 5 ans est inférieur à 7 à 10 %, ce qui suggère que c'est l'un des pires types de cancer que la médecine moderne n'a pas réussi à conquérir.
Taux de récidive élevé : Le glioblastome présente un schéma de croissance invasif, donc même si la tumeur visible est complètement retirée par chirurgie, des cellules cancéreuses microscopiques infiltrées dans les tissus cérébraux normaux environnants restent, et plus de 90 % des patients connaissent une récidive. Après la récidive, il n'existe pas de traitement standard approprié, et la durée de survie est réduite à quelques mois.
Les raisons pour lesquelles le traitement du glioblastome échoue sont dues à deux énormes barrières.
Barrière physique (Barrière hémato-encéphalique, BBB) : Les cellules endothéliales des vaisseaux cérébraux sont reliées par des jonctions serrées (Tight Junction) qui bloquent plus de 98 % des substances dans le sang. La plupart des médicaments ayant un poids moléculaire supérieur à 400 daltons (Da) ne peuvent pas traverser cette barrière, et en particulier, les molécules de grande taille comme les anticorps ou les cellules immunitaires ont un taux d'atteinte du parenchyme cérébral de moins de 0,1 % lors d'une administration systémique (injection intraveineuse). Cela pose le problème de l'échec de la livraison, même si des agents anticancéreux puissants sont développés.
Barrière immunologique : Le glioblastome est un exemple typique de "tumeur froide". Il y a peu d'infiltration de cellules T à l'intérieur de la tumeur, et les cellules tumorales sécrètent des substances immunosuppressives puissantes (comme TGF-β) qui neutralisent même les cellules immunitaires infiltrées. En conséquence, les inhibiteurs de points de contrôle immunitaire (comme les inhibiteurs de PD-1) qui ont montré des effets miraculeux dans le mélanome ou le cancer du poumon ont échoué de manière désastreuse dans le traitement du glioblastome.
L'étude de l'équipe du professeur Stephen Ahn propose une stratégie qui contourne et frappe simultanément ces deux barrières, c'est-à-dire une approche innovante d'introduction de cellules immunitaires "renforcées" par un contournement appelé "nez".
Les efforts de l'humanité pour surmonter la barrière hémato-encéphalique (BBB) se poursuivent depuis des décennies. L'administration de fortes doses d'agents anticancéreux a provoqué une toxicité systémique (suppressions de la moelle osseuse, toxicité hépatique), et l'utilisation de mannitol pour ouvrir temporairement la BBB comportait des risques d'œdème cérébral. Récemment, des techniques utilisant des ultrasons pour ouvrir localement la BBB ont été tentées, mais nécessitent encore des équipements et des procédures complexes. L'administration intranasale, à laquelle l'équipe du professeur Stephen Ahn a prêté attention, utilise le seul passage anatomique du corps qui relie directement l'environnement extérieur au système nerveux central (SNC).
L'épithélium olfactif dans la partie supérieure du nez expose des cellules nerveuses olfactives. L'axone de ces cellules nerveuses se connecte directement au bulbe olfactif du cerveau à travers de minuscules trous dans la plaque cribriforme.
Espace périneural : Les médicaments ou les cellules peuvent se déplacer à l'intérieur des cellules nerveuses (Intraneuronal), mais il est plus probable qu'ils se déplacent à travers l'espace périneural qui entoure les faisceaux nerveux. Cet espace est continu avec l'espace sous-arachnoïdien où circule le liquide céphalorachidien (LCR), permettant ainsi d'entrer dans le LCR sans passer par la barrière hémato-encéphalique.
Vitesse : Le transport interne des nerfs est un processus lent qui prend plusieurs jours, tandis que le transport extracellulaire à travers l'espace périneural agit comme une autoroute qui peut atteindre le tissu cérébral en quelques dizaines de minutes.
Si le nerf olfactif se connecte à l'avant du cerveau (près du lobe frontal), le nerf trijumeau, largement distribué dans toute la muqueuse nasale, se connecte à la partie centrale du cerveau, le tronc cérébral et le pont. La recherche du professeur Stephen Ahn vise à utiliser ces deux voies pour délivrer des cellules immunitaires non seulement à l'avant du cerveau, mais aussi aux tumeurs situées en profondeur. L'équipe de recherche a déjà vérifié cette possibilité par des expériences animales avant la sélection de ce projet national. Dans des études antérieures, lorsque des agents de thérapie cellulaire comme les cellules CAR-T (cellules T à récepteur antigénique chimérique) ont été administrés par voie intranasale, il a été confirmé que ces cellules migrent efficacement vers la zone tumorale cérébrale et montrent un effet antitumoral significatif. Cela est possible non seulement parce que le médicament se diffuse, mais parce que des cellules vivantes utilisent leur capacité de "homing" pour rechercher activement la tumeur en suivant des signaux de chimiokines.
La "thérapie cellulaire adoptive (Thérapie Cellulaire Adoptive, ACT)" est une méthode de traitement qui extrait des cellules immunitaires du corps du patient, les renforce/modifie, puis les réinjecte. L'équipe du professeur Stephen Ahn utilise des cellules hautement ingénierées adaptées aux caractéristiques du glioblastome, plutôt que de simples cellules immunitaires. Les cellules CAR-T, qui ont montré des effets miraculeux dans les cancers hématologiques, sont des cellules T équipées de récepteurs (CAR) qui reconnaissent des protéines spécifiques à la surface des cellules cancéreuses.
Cible : Dans le cas du glioblastome, EGFRvIII (une protéine mutante qui n'existe pas dans les cellules normales mais uniquement dans le glioblastome) et IL13Rα2 sont les principales cibles.
Avantages de l'administration intranasale : Les cellules CAR-T administrées par voie intraveineuse sont souvent piégées dans les poumons ou le foie (effet de premier passage), mais l'administration intranasale permet d'atteindre directement le cerveau sans cette perte systémique, ce qui peut offrir un effet thérapeutique élevé même à faible dose.
Le professeur Stephen Ahn a également concentré ses recherches sur les cellules NK (cellules tueuses naturelles) et les cellules T gamma-delta. Le glioblastome peut cacher ses protéines cibles (perte d'antigène) pour éviter l'attaque des cellules CAR-T, mais les cellules NK sont des cellules immunitaires innées qui peuvent attaquer les cellules cancéreuses en ignorant ces mécanismes d'évasion. L'équipe de recherche construit une plateforme capable de transporter divers "armes" comme les cellules CAR-T, NK et gamma-delta T selon les caractéristiques des patients par voie intranasale.
L'une des réalisations les plus originales de l'équipe du professeur Stephen Ahn est la méthode utilisant des cellules souches génétiquement modifiées. Selon une étude publiée en 2025 dans la revue internationale Biomedicine & Pharmacotherapy, l'équipe a intégré le gène interleukine-12 (IL-12) dans des cellules souches mésenchymateuses (MSC) qui ont une capacité de tropisme tumoral élevée.
Mécanisme : Les MSC administrées par voie intranasale ou locale pénètrent profondément dans la tumeur.
Action : Les MSC sécrètent de l'IL-12 à l'intérieur de la tumeur. L'IL-12 est une cytokine immunoactive puissante qui réveille les cellules NK et T dormantes environnantes pour attaquer la tumeur.
Résultats : Lorsque cette méthode a été combinée avec des inhibiteurs de points de contrôle immunitaire PD-1, un taux de 50 % de rémission complète a été observé dans des modèles murins, et un effet de 'mémoire immunologique' a été prouvé, car même après réinjection de cellules cancéreuses après le traitement, il n'y a pas eu de récidive.
L'étude de l'équipe du professeur Stephen Ahn n'est pas une tentative isolée, mais se trouve à la pointe de la compétition mondiale pour les technologies de traitement des tumeurs cérébrales de nouvelle génération. Comparé à d'autres équipes de recherche majeures aux États-Unis, l'approche de l'équipe de l'hôpital St. Mary de Séoul occupe une position unique en raison de la combinaison de "non-invasivité" et "d'ingénierie cellulaire".
En 2025, l'équipe de l'Université de Pennsylvanie a publié des résultats cliniques révolutionnaires dans Nature Medicine. Ils ont réussi à réduire la taille de la tumeur en administrant un "CAR-T à double cible" qui frappe simultanément EGFRvIII et IL13Rα2 chez des patients atteints de glioblastome récurrent.
Limites : L'équipe de Penn a percé le crâne pour envoyer des cellules au cerveau et a inséré un tube appelé "réservoir Ommaya" pour injecter directement dans le ventricule. Bien que cela soit une méthode de livraison sûre, elle nécessite une chirurgie, comporte des risques d'infection et cause une grande souffrance au patient.
Comparaison : La méthode d'administration intranasale de l'équipe Ahn a le potentiel d'être un "Game Changer" capable d'obtenir des effets similaires sans chirurgie.
L'équipe de l'Université de Washington a publié en 2025 dans PNAS des résultats sur le traitement du glioblastome en administrant des nanoparticules appelées "acides nucléiques sphériques" par voie intranasale.
Approche : Des nanoparticules d'or ont été recouvertes de substances immunoactives et administrées par voie intranasale, activant l'environnement immunitaire de la tumeur cérébrale.
Comparaison : La méthode de WashU se concentre sur la livraison de "médicaments (nanoparticules)", tandis que l'équipe Ahn livre des "cellules". Les cellules, contrairement aux médicaments, peuvent se déplacer, se multiplier et réagir aux changements de la tumeur, ce qui peut être plus favorable pour surmonter le microenvironnement complexe du glioblastome.
Cette recherche, soutenue par le ministère des Sciences et des Technologies de l'information et de la communication (300 millions de wons sur 3 ans), se concentre sur l'acquisition de données concrètes pour une application clinique au-delà des expériences fondamentales.
Cartographie des voies : En utilisant des cellules immunitaires marquées par fluorescence, nous visualiserons quelles voies les cellules empruntent principalement entre le nerf olfactif et le nerf trijumeau lors de l'administration intranasale, et où elles s'accumulent dans le cerveau.
Ingénierie cellulaire : Nous intégrons des technologies pour surexprimer des protéines (par exemple, le récepteur de chimiokine CXCR4) qui aident les cellules immunitaires à bien s'attacher à la muqueuse nerveuse ou à se déplacer plus rapidement dans l'espace périneural. Cela vise à empêcher les cellules d'être expulsées par un écoulement nasal ou des éternuements et à maximiser l'efficacité de leur déplacement vers le cerveau.
Évaluation de la sécurité et de la toxicité : Nous vérifions si les cellules immunitaires atteignant le cerveau provoquent une neurotoxicité (toxicité neuronale) en attaquant les cellules cérébrales normales ou entraînent une réaction inflammatoire excessive.
Le professeur Stephen Ahn a déclaré dans une interview : "Une fois cette recherche établie, elle pourrait évoluer vers une 'plateforme universelle' applicable non seulement au glioblastome, mais aussi à d'autres maladies du système nerveux central telles que les métastases cérébrales, la maladie d'Alzheimer et la maladie de Parkinson." La technologie d'envoi de "cellules" au cerveau de manière non chirurgicale pourrait également être appliquée pour délivrer des cellules souches afin de régénérer les nerfs dans les maladies cérébrales dégénératives.
Le glioblastome a été le tombeau de nombreux nouveaux médicaments au cours des dernières décennies. La barrière hémato-encéphalique, une forteresse, et les caractéristiques immunologiques d'une tumeur froide ont neutralisé les stratégies anticancéreuses existantes. Cependant, le traitement par "thérapie cellulaire adoptive basée sur l'administration intranasale" de l'équipe du professeur Stephen Ahn de l'hôpital St. Mary de Séoul est considéré comme une percée innovante pour surmonter cette impasse.
Si cette recherche est menée à bien, un avenir comme suit s'ouvrira.
Amélioration de la qualité de vie des patients : Les patients pourront recevoir un traitement par cellules immunitaires sous forme de spray nasal ou de gouttes en ambulatoire, sans chirurgie répétée ou hospitalisation, ce qui réduira considérablement leur souffrance.
Augmentation de l'efficacité du traitement : En frappant directement la zone tumorale avec une forte concentration de cellules immunitaires sans effets secondaires systémiques dus à l'administration intraveineuse, l'efficacité du traitement peut être maximisée.
Prévention des récidives : La possibilité de bloquer fondamentalement la récidive, le plus grand problème du glioblastome, s'ouvre grâce à la formation de mémoire immunologique.
La recherche du professeur Stephen Ahn n'innove pas seulement dans le développement de nouveaux médicaments, mais révolutionne les "voies" de livraison de médicaments et conçoit des "cellules" optimisées pour ces voies. La période de recherche de trois ans qui commence en 2026 sera un tournant important pour que la Corée puisse faire un bond en avant en tant que "premier acteur" dans le domaine de la neuro-oncologie mondiale. Nous sommes maintenant témoins d'un tournant historique où le glioblastome, considéré comme une maladie incurable, pourrait devenir une "maladie chronique gérable" ou "une maladie guérissable".

